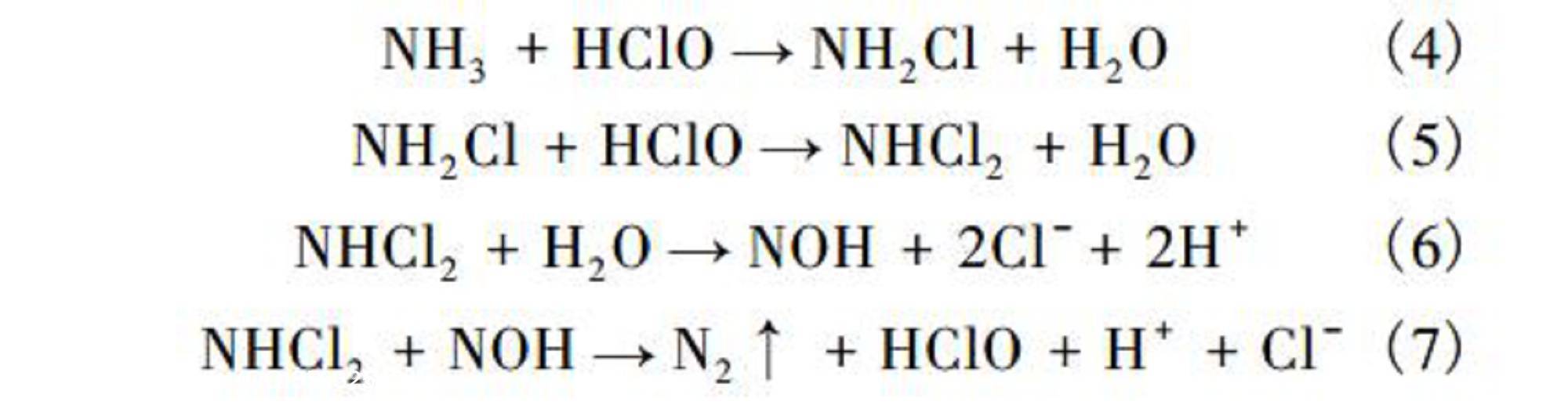| 发布时间:2020-01-03 17:07:46 | 来源:本站原创 | 作者:贾晓玲,柯水洲,朱佳 | 浏览次数: |
引 言
化学镀镍又称为无电解镀镍,属于特种电镀,是在高温下使用还原剂将镍离子还原为金属镍,并在镀件表面沉积的过程,是近几年国内外发展较快的表面处理技术之一。镀件过程中不仅需要添加次磷酸钠等还原剂及硫酸镍等镍盐,为保证镀液的稳定性和镀层的质量,还需向镀液中不断补加光亮剂、配位剂和pH值缓冲剂等药剂。因此,废水中含有大量镍离子、有机物、次磷酸钠、氨氮和微量其他金属杂质等,污染物种类多,成分复杂。其中,氨氮主要来源于镀镍过程中使用的氨水、氯化铵等,有些柠檬酸铵等络合剂还会使废水中的氨氮含量进一步升高,增加了废水的处理难度。
调研结果显示:广东省电镀企业难和较难达标的前8项污染物指标为总镍、COD、氨氮、总铜、总磷等,氨氮是难达标的指标之一。同时意味着经过一般工艺处理后,仍有较多企业的化学镀镍废水无法达到GB21900—2008《电镀污染物排放标准》。目前,化学镀镍废水中的镍已得到良好的回收处理及利用,其他一些处理技术研究也主要集中在去除废水中有机污染物,而氨氮却常被忽略。并且随着全国废水排放标准的日益提高,废水中残留氨氮的要求也越来越高。广东省现有企业均按照GB21900—2008表2中的要求,氨氮的排放限值定为15mg/L。而新建企业氨氮浓度须低于8mg/L。因此,去除氨氮成为电镀行业废水处理中急需解决的一大问题。
在脱除氨氮的众多物化方法中,次氯酸钠氧化法具有反应速度快,去除效率高等特点,因简单易行而备受关注。与传统的氯系氧化剂液氯相比,次氯酸钠使用安全,无氯气外泄危险,可进一步减少消毒副产物的产生。目前,对次氯酸钠氧化脱除氨氮的研究主要集中在稀土冶炼废水、ADC发泡剂废水、石化废水等方面,废水氨氮浓度大多<50mg/L或>200mg/L,次氯酸钠去除氨氮效果较为显著。关于电镀废水方面的研究也相对较少,余华东等利用次氯酸钠处理电镀工业园污水厂的生化出水,出水氨氮可达标排放。由于投加次氯酸钠脱除氨氮的原理是次氯酸钠将氨氮氧化为氮气逸出,脱除彻底,不会转换为硝态氮而增加总氮含量,且该厂排污许可证对总氮的排放限值未作要求。故本研究以GB21900—2008表2(氨氮限值15mg/L)为目标,考察NaClO溶液投加量、反应时间、初始pH值及反应温度等因素对氨氮去除效果的影响,探究次氯酸钠氧化作为深度处理方式脱除化学镀镍废水中的剩余氨氮是否可行。
1、试验部分
1.1、废水来源及水质
广东省深圳市某工业园的化学镀镍废水经过树脂过滤罐、含镍废水调节池、混凝反应池、絮凝反应池、斜管沉淀池、中间储水池、过滤罐等构筑物处理后,出水ρ(总镍)<0.08mg/L、ρ(SS)<20mg/L,但ρ(氨氮)仍较高,为100~120mg/L。以上述镀镍废水出水为试验对象,氨氮浓度为120mg/L左右,pH为6.0~7.0,每次试验取废水200mL。
1.2、试验药品与仪器
试验药品:NaClO溶液(有效氯含量8%)、98%浓硫酸、NaOH,所用药品均为分析纯。
试验仪器:SQP型电子天平(赛多利斯科学仪器有限公司);德国IKACOLORSQUID系列磁力搅拌器;THD-0515低温恒温槽;SHZ-B恒温振荡器;pH3210SET-2便携式pH测试仪;T6系列紫外可见分光光度计(北京普析通用仪器有限公司)。
1.3、水质分析方法
氨氮(NH3-N)采用纳氏试剂比色法测定。pH采用pH3210SET-2型便携式pH仪测定。
1.4、试验方法
对预处理后的镀镍废水出水进行间歇式烧杯试验。过程如下:取水样200mL于锥形瓶中,用浓硫酸或氢氧化钠调节pH值,依据设定的次氯酸钠投加量加入NaClO溶液,开启磁力搅拌器(300r/min),反应过程根据需要定时取样测定水样中的氨氮浓度。每次试验设2个平行样,结果取平均值。
2、试验结果与分析
2.1、NaClO溶液投加量对氨氮去除率的影响
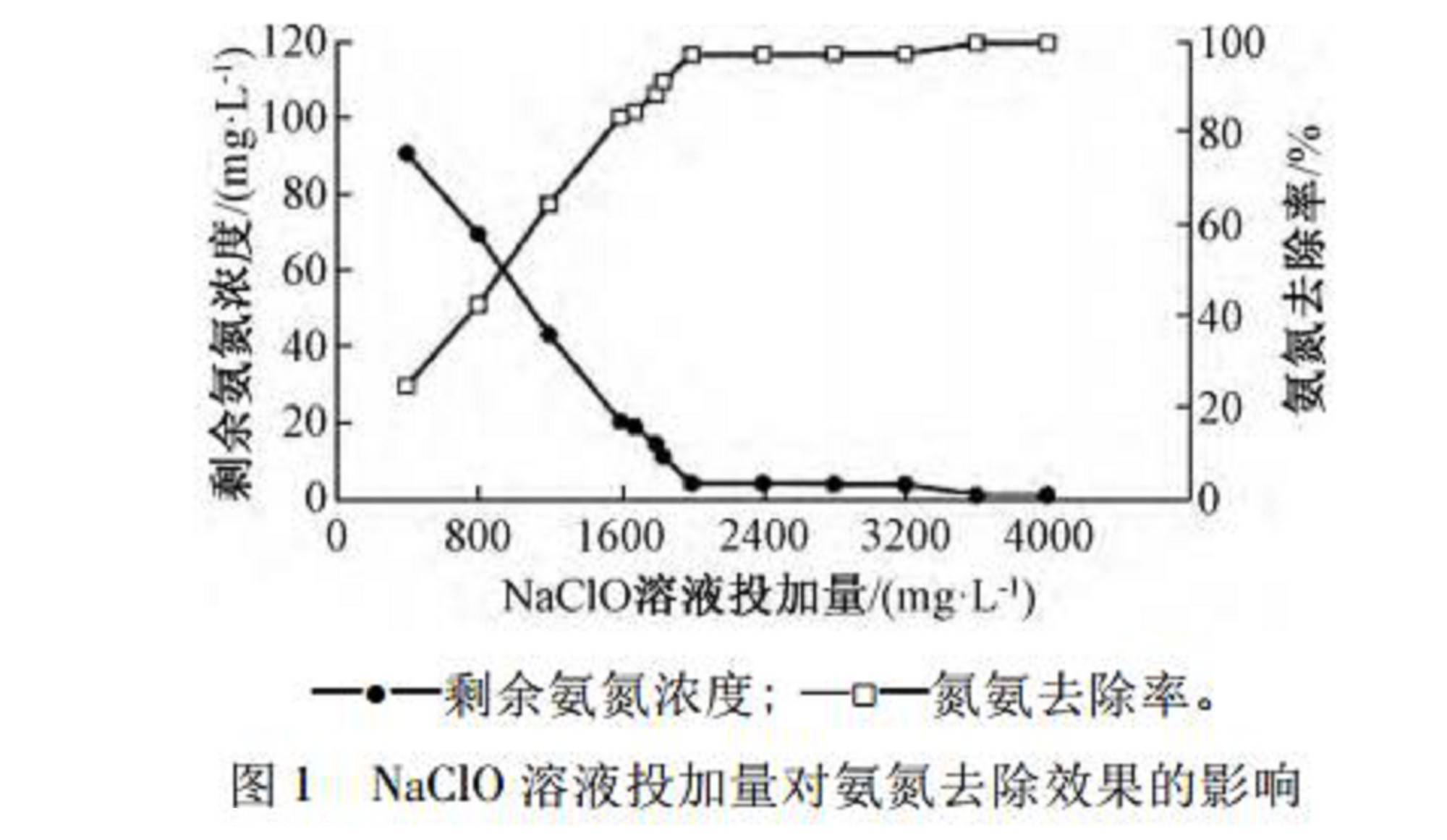
室温(25~27℃)下,根据初步探索试验,确定pH=2.0,反应时间为30min,磁力搅拌器转速为300r/min的反应条件。取废水200mL,用硫酸调节pH至2.0,分别投加400~4000mg/L的NaClO溶液,开启磁力搅拌器,30min反应结束后取样检测废水剩余氨氮浓度,NaClO溶液投加量对氨氮去除效果的影响如图1所示。
由图1可知:NaClO投加量较小时,随着投加量增大,氨氮浓度不断降低,去除率显著上升。NaClO溶液投加量为400mg/L时,反应结束后,水样中剩余氨氮浓度为90.3mg/L,去除率仅为24.50%。这主要是由于废水中存在部分比氨氮更易氧化的物质,如有机物等。随着投加量增大,次氯酸钠开始主要和氨氮反应,当次氯酸钠投加量大于1800mg/L时,剩余氨氮浓度为14.1mg/L,去除率上升至88.21%。当NaClO溶液投加量增大至2000mg/L时,曲线出现了明显的拐点,水样中剩余氨氮浓度为3.8mg/L,去除率高达96.81%。随后继续增大NaClO溶液投加量,剩余氨氮减少速度缓慢。这表明废水中能被氧化的氨氮基本已被氧化完全,去除效果开始趋于稳定,剩余氨氮浓度小于5mg/L。当NaClO溶液投加量大于3600mg/L时,剩余氨氮浓度小于1mg/L,氨氮去
除率高达99.33%。
从理论上分析,次氯酸钠与氨氮反应的总方程式为:
由式(1)可知:用NaClO将1g氨氮全部氧化需要7.6g有效氯,故氧化1L废水中的0.12g氨氮需要0.912g有效氯,NaClO理论投加量为912mg/L。但结果表明:NaClO理论投加量为912mg/L时,氨氮去除率低于60%,COD去除率高于10%。次氯酸钠实际消耗量远超过理论消耗量。胡小兵等利用次氯酸钠氧化处理电镀综合废水时也发现,次氯酸钠投加量远超过理论值才能保证氨氮的去除率。
2.2、反应时间对氨氮去除率的影响
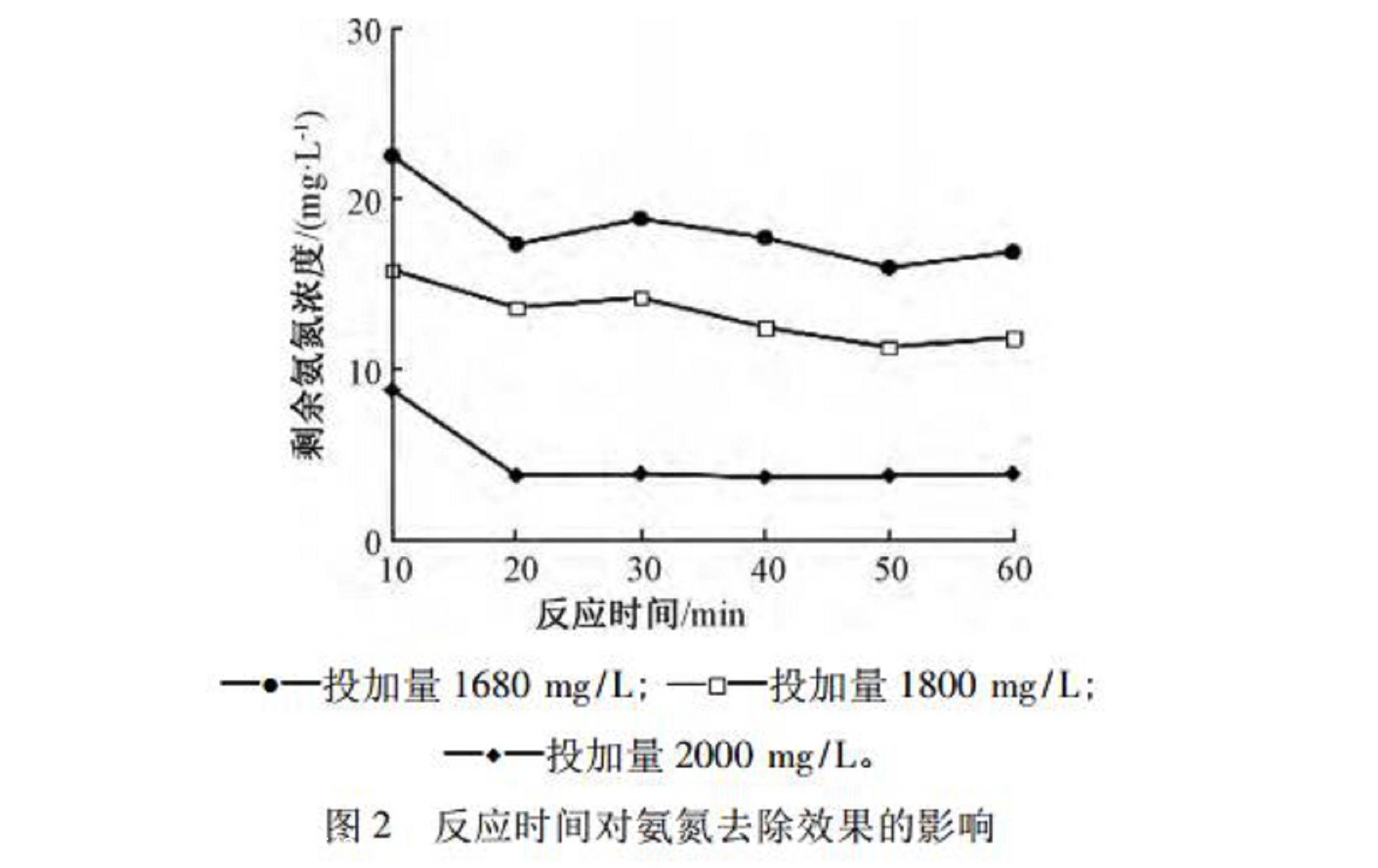
室温(25~27℃)下,取废水200mL,在pH=2.0,磁力搅拌器转速为300r/min的条件下,分别投加1680,1800,2000mg/LNaClO溶液,反应开始后每隔10min取样,检测废水剩余氨氮浓度。考察3种NaClO溶液投加量下,反应时间对次氯酸钠氧化脱除氨氮效果的影响,结果如图2所示。
由图2可知:不同NaClO溶液投加量下反应时间对氨氮脱除效果的影响规律基本一致,随着时间增加,剩余氨氮浓度不断降低。次氯酸钠氧化脱除氨氮反应是一个快速反应,反应开始阶段氨氮浓度迅速降低,反应10min时已低于25mg/L。反应20min后,剩余氨氮浓度变化较小,逐渐稳定在17.0,12.0,4.0mg/L,此时反应基本完全,3种NaClO溶液投加量的氧化反应均趋于平衡。由于调节好pH需要一定时间,反应完全后气体逸出也需要一段时间,并且实际工程中水量更大,药剂与废水混合速度不及小试试验快,因此将反应时间设置为30min以保证混合均匀、反应完全。反应时间为30min时,NaClO溶液投加量分别为1680,1800,2000mg/L时,对应剩余氨氮浓度为18.7,14.1,3.8mg/L。综合考虑氨氮去除率及实际工程应用成本,NaClO溶液投加量确定为1800mg/L,此时出水氨氮浓度为14.1mg/L,低于GB21900—2008表2的氨氮排放限值15mg/L。
2.3、初始pH值对氨氮去除率的影响
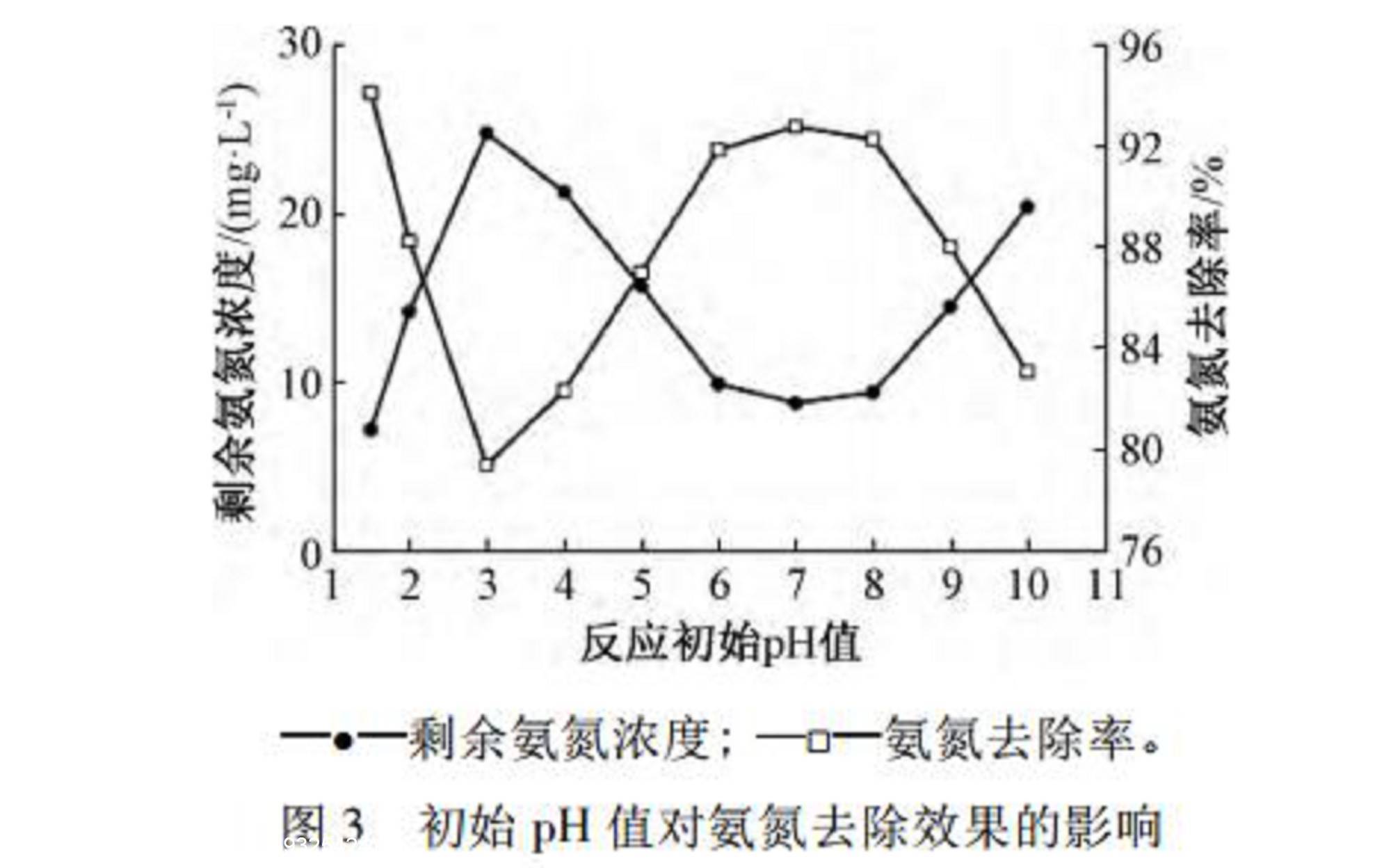
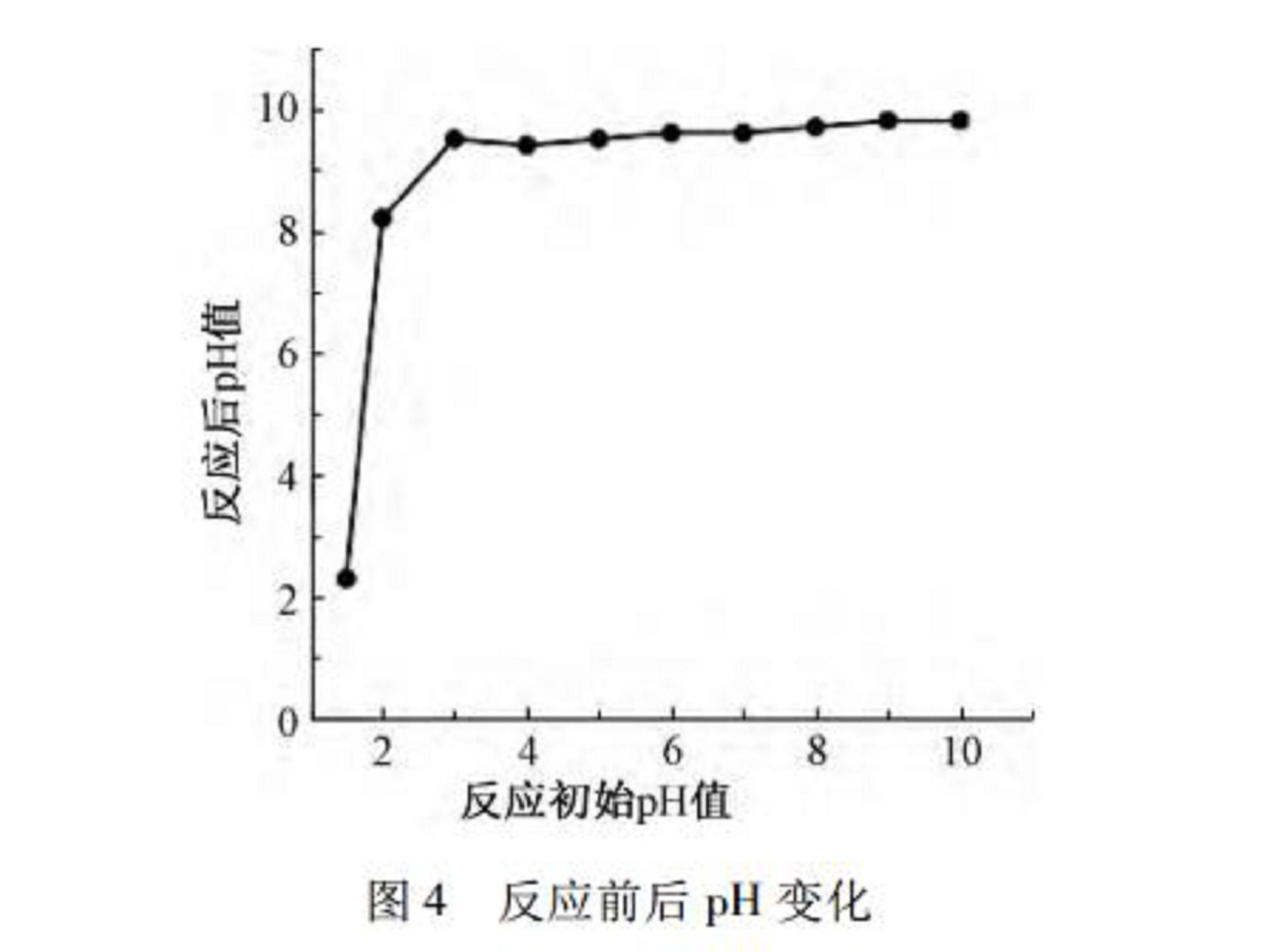
室温(25~27℃)下,取废水200mL,将初始pH值分别调节至不同值,在转速为300r/min,NaClO溶液投加量为1800mg/L的条件下,30min反应结束后检测废水剩余氨氮浓度,初始pH值对次氯酸钠氧化脱除氨氮效果的影响如图3所示。同时为进一步确定适宜的pH,检测不同初始pH值对应的反应结束后pH值,如图4所示。
由图3可知:随着初始pH值升高,氨氮的去除率整体趋势为先减小后增大再减小。研究表明:pH值不仅影响NaClO溶液的组成,进而影响溶液氧化性的强弱。NaClO溶液的氧化性主要是由于次氯酸钠水解产生的HClO,反应式如下:
pH低于2.0时,NaClO溶液有效成分主要为Cl2;pH高于9.0时,主要成分为ClO。故强酸和强碱条件下,NaClO溶液的氧化性能不佳。
当pH为1.5时,NaClO溶液成分主要为Cl2,氧化性能不佳。但试验过程中观察到随着时间延长,水中开始产生大量气泡,反应剧烈,反应结束后剩余氨氮浓度为7.1mg/L。由图4可知:其原因可能是pH增大至2.0以上,水中HClO增多,氧化性能得到提升。
当pH在1.5~3.0内,氨氮去除率迅速下降,由94.06%降至79.35%。由次氯酸钠的半反应及能斯特方程可知,随着pH升高,NaClO溶液氧化电位下降,氧化能力变弱,故氨氮去除率不断下降。
在pH为3.0~7.0内,氨氮去除率随pH升高而上升,峰值达92.73%。NaClO溶液的主要成分为HClO,氧化能力强;且由于气态NH3比NH+更易被HClO氧化,且废水中存在如式(3)的平衡:
随着pH升高,NH3浓度越大,NH3-N越容易被氧化成N2,去除率开始不断上升。
当pH高于7.0时,NaClO溶液中ClO-含量开始增大,氧化电位下降速度较快,去除率开始不断下降。
由图4可知:投加NaClO溶液后,反应后pH较初始pH值均有上升。尤其初始pH值在2.0~6.0内,反应后pH大幅上升。次氯酸钠和氨氮的反应机理如下:
由式(6)可知:反应过程中有H+产生,会使pH有所下降,但因NaClO水解产生的NaOH使pH不断升高。
由于预处理后废水pH为6.0~7.0,且pH排放要求在6.0~9.0内,若初始pH设置为2.0,反应前需加大量酸调节,反应后pH值为8.2,满足pH排放要求;若初始pH设置为6.0~7.0,反应前无需调节初始pH值,但反应后pH值为9.6左右,略高于排放标准上限,需投加酸调节至9.0以下,成本低于初始pH值为2.0时的情况。
结合图3综合考虑,若初始pH设置为6.0~7.0,剩余氨氮浓度低于10mg/L,氨氮去除率达92%左右,高于初始pH为2.0时的88.21%。因此,初始pH值设置为6.0~7.0。
2.4、反应温度对氨氮去除率的影响
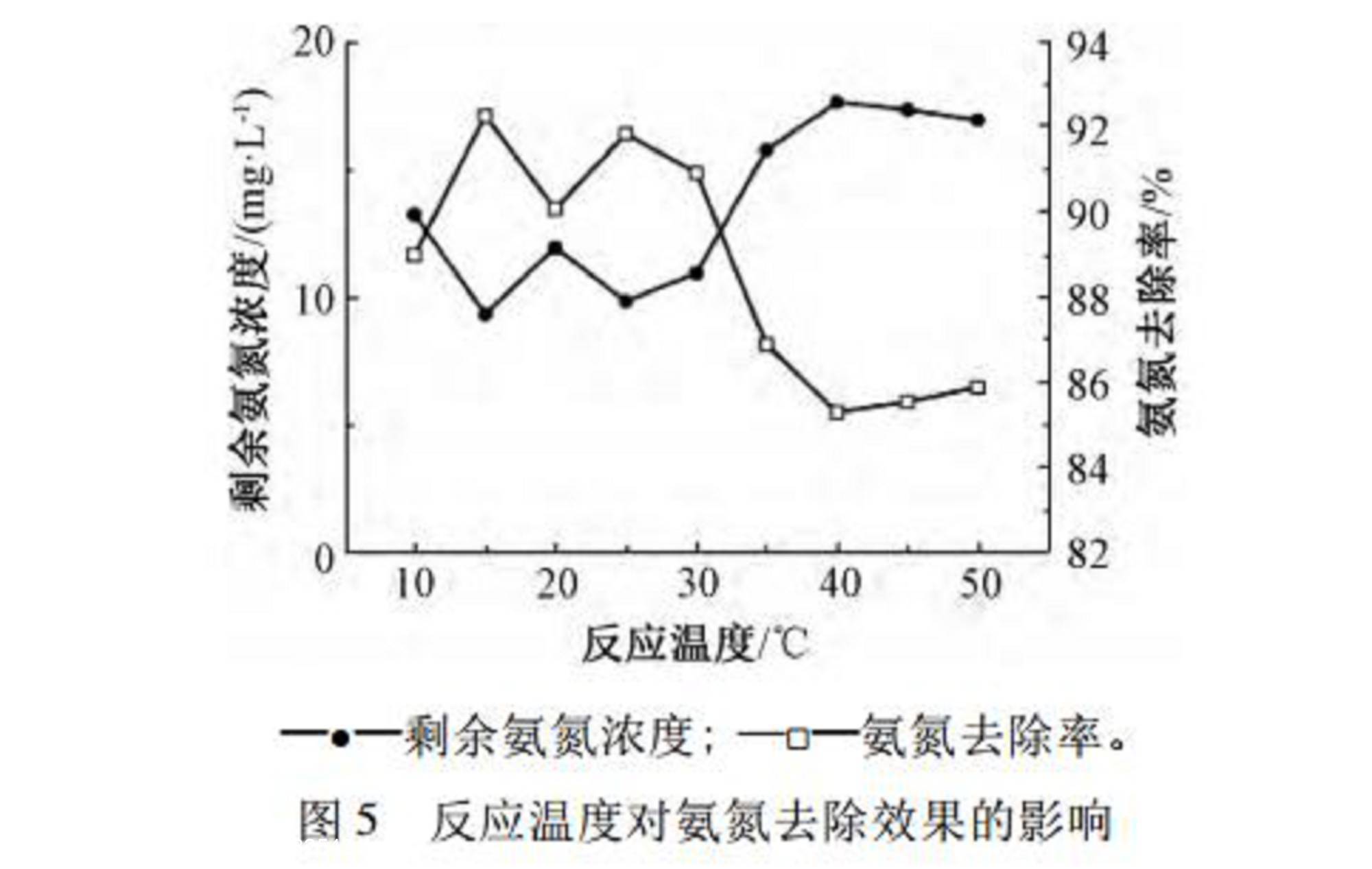
取废水200mL,在初始pH值为6.0~7.0,转速为300r/min,NaClO溶液投加量为1800mg/L的条件下,改变反应温度,30min反应结束后检测废水剩余氨氮浓度。考察温度对次氯酸钠氧化脱除氨氮效果的影响,如图5所示。
由图5可知:当温度较低时,氧化反应速率较慢,氨氮去除率较低。反应温度为10℃时,剩余氨氮浓度为13.2mg/L,氨氮去除率为88.96%。随着温度的升高,反应速率逐渐增大,在15~30℃时,剩余氨氮浓度为10mg/L左右,去除率约为91%。当温度更高,反应速率继续增大,但由于次氯酸钠极不稳定,次氯酸钠的分解速度明显加快,分解反应见式(8):
此时,有效氯利用率降低,氨氮去除率也随之下降至86%。当水温超过35℃,剩余氨氮浓度>15mg/L。因此,反应温度为10~30℃,剩余氨氮浓度均低于15.0mg/L,满足排放要求。在此范围内,温度对次氯酸钠氧化脱除氨氮效果的影响较小,故实际工程应用可在室温(10~30)℃下进行,无需改变反应温度,可减少耗能、降低成本。
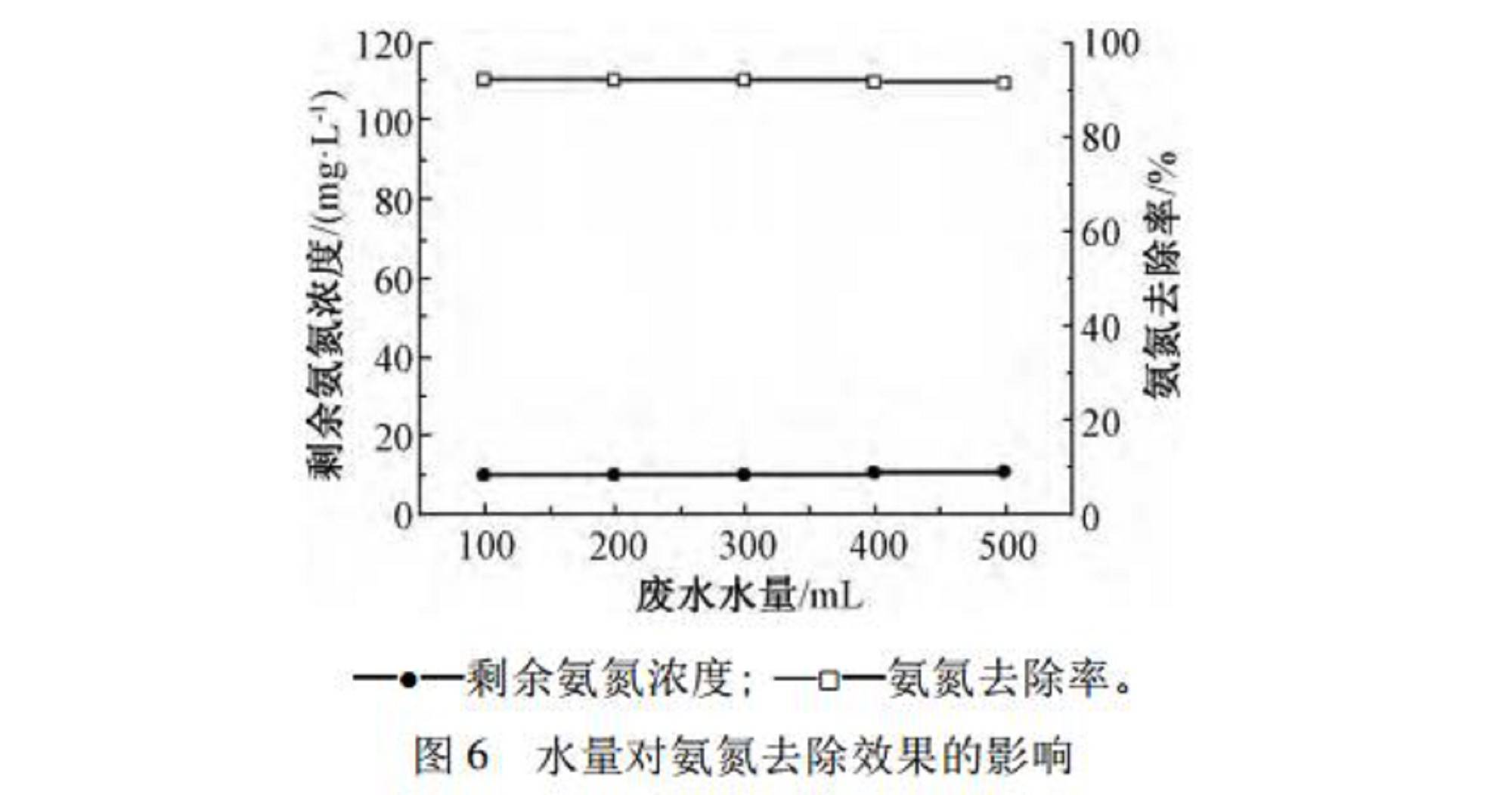
2.5、反应稳定性试验
根据4种影响因素试验的结果,可得出采用次氯酸钠氧化脱除该镀厂化学镀镍废水中氨氮的适宜反应条件为:NaClO溶液投加量为1800mg/L,反应时间为30min,初始pH值为6.0~7.0,反应温度为10~30℃。现分别取100,200,300,400,500mL废水,在此条件下进行试验,结果如图6所示。可知:废水水量从100mL增加到500mL,去除效果稳定。结果表明:在试验所确定的条件下,次氯酸钠能够氧化脱除该化学镀镍废水中的氨氮,满足GB21900—2008中表2的要求。
3、结论
次氯酸钠氧化法脱除化学镀镍废水中剩余氨氮的试验发现:氨氮去除率随次氯酸钠投加量增加而增大,之后趋于平衡;次氯酸钠和氨氮的反应快速,适当延长反应时间可使反应更加充分,提高次氯酸钠利用率;强酸性和中性条件下,氨氮去除率较高;反应温度在10~30℃内对氨氮去除效果影响较小,高温不利于去除氨氮。在NaClO溶液投加量为1800mg/L,反应时间为30min,初始pH值为6.0~7.0,磁力搅拌器转速为300r/min,温度为10~30℃的条件下,出水剩余氨氮浓度为10mg/L左右,去除率高达91%,满足GB21900—2008中表2的要求。结果表明:采用次氯酸钠氧化作为深度处理方式脱除化学镀镍废水中的氨氮简单可行、快速高效、出水稳定。